
EMSA探针设计
经典EMSA是使用放射性同位素(一般为P32)标记探针。由于P32的短寿命与放射性,用P32标记探针只能经实验者全手工用末端转移酶或激酶进行标记。 如果顺利,2天左右能获得探针,但10多天后又要重新进行标记。市场上的EMSA探针末端标记产品适合于同位素标记,对非放射性标记没有什么用。
现在已很少有人用P32标记探针做EMSA了。非放射性EMSA探针常采用生物素,荧光或地高辛(DIG)。非放射性分子标记EMSA探针的最大好处是可以 在核酸合成过程中进行标记,具有高效,省时,费用低的优点。
一、非放射性探针制作需掌握下面几点:
(1)文献查找与分析:1)如果利用实验者自测的基因序列做EMSA,需要对其进行分析寻找TF结合序列,并与文献进行比对。2)在文献中可以查
到大多数TF的结合序列,但最好进行交叉验证以防出错。
3)需要注意文献发表的探针序列可能并不适合做非放射性EMSA(见下面解释)。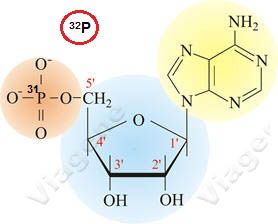
(2)探针设计:须注意
1)防止探针封闭成环,2)防止错位配对,3)排除目标序列以外结合位点的,4)防止产生空间位阻,5)适当考虑AT/GC比例,6)一般EMSA探针只有几十碱基对。探针太长会产生过多结合位点导致结果分析困难,还会产生超级螺旋结构而掩盖结合部位。
(3)核酸合成:1)合成量不能太少,量太少不准确,易产生多余的单链。2)需要HPLC纯化。3)如果是RNA探针,要防止降解。
(4)生物素或荧光标记:1)建议采用Biotin或红外荧光标记,尽量不要采用DIG标记。2)标记只能在探针末端。3)为提高灵敏度,探针两端都须有标记。
(5)质谱分析:用质谱对探针进行纯度与分子量分析,以防出错。
(6)双链制作:对配对的单链需进行仔细计算,确保互补链为等当量反应。探针中的多余单链所引起高背景,使非特异带增加,致结果分析困难。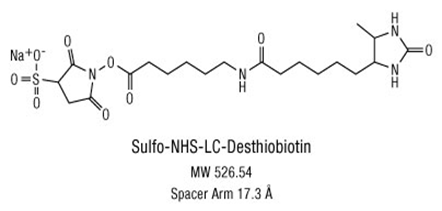
(7)比活性测定:新制作的探针需要稀释后才能直接用于EMSA。稀释度是通过将新探针做不同稀释度后与已知量探针进行比活性测定来确定的。
(8)制作应用液:按比活性确定稀释倍数,用TE稀释制作探针应用液,-20保存。
二、探针空间位阻问题:
在32P标记的探针中,磷酸基团是DNA本身的结构。用放射性P32代替P31的最大的好处是探针标记只增加了1个电子(图1),对探针的化学结构与结合能力的影响可忽略不计,EMSA结果最恒定。
我们比较放射性与非放射性EMSA时发现一些转录因子用P32探针能够出结果,但改用非放射性探针后就不能出结果。
一些转录因子用放射性探针与非放射探针的EMSA结果不一致。我们的进一步分析显示探针用非放射性分子标记导致结果不一致的主要原因。对核酸探针而言,
非放射性标记物都属于外加分子(图2为生物素标记物,图3为荧光分子标记物)。为提高灵敏度,常常在探针两端都进行标记。标记后的分子都会使原来的探针增加至少1000-2000道尔顿。如果采用文献报道的长度为20-22碱基(6-7千道尔顿)的EMSA探针,
标记物占探针分子的比例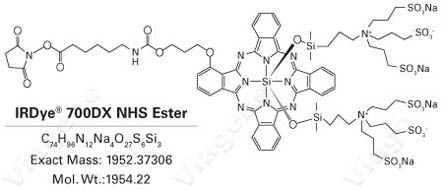 很高。另一方面,用生物素标记的探针在与TF结合后还需要有足够空间与Avidin-HRP(分子量~100K)结合。此外,外加的标记物还可能影响到探针的电荷状态,形成聚合物,出现沉淀。
很高。另一方面,用生物素标记的探针在与TF结合后还需要有足够空间与Avidin-HRP(分子量~100K)结合。此外,外加的标记物还可能影响到探针的电荷状态,形成聚合物,出现沉淀。
由于我们的产品开发是从放射性EMSA过度到非放射性EMSA的,我们有条件将非放射性探针进行各种比较,并找出可能解决方案并进行验证。我们发现一些探针需改变长度,一些需变更结合,一些需加入非离子去污剂才能获得满意结果。一些客户做不出理想EMSA,探针问题可能是其中一个重要原因。

 客服一号
客服一号
